激活大脑“清洁工”!Nat Aging:ACE 蛋白让小胶质细胞重获“噬”斑能力,或可逆转阿尔茨海默病?
来源:生物谷原创 2025-08-11 09:23
这项研究的意义不仅在于发现了 ACE 的新功能,更提供了一种潜在的细胞疗法思路:通过改造小胶质细胞细胞增强 ACE 表达,或许能克服 AD 中常见的免疫细胞功能缺陷。
阿尔茨海默病(AD)正以惊人的速度吞噬着全球老年人的记忆与尊严。世界卫生组织数据显示,目前全球约有 5000 万 AD 患者,预计到 2050 年这一数字将飙升至 1.52 亿;仅美国就有超 700 万人受其困扰。这种进行性神经退行性疾病不仅让患者逐渐丧失认知与自理能力,更给家庭和社会带来了难以估量的负担。
近日,发表在《Nature Aging》杂志上的一项突破性研究,为 AD 治疗带来了新曙光。来自西达赛奈医疗中心的科学家团队发现,通过增强小胶质细胞中血管紧张素转换酶(ACE)的表达,可显著逆转 AD 模型小鼠的病理损伤和认知障碍——这意味着,大脑中这群“疲惫的清洁工”或许能被重新激活,夺回对抗疾病的主动权。

AD 的核心病理特征之一,是大脑中 β- 淀粉样蛋白(Aβ)异常沉积形成的斑块。这些斑块会破坏神经元连接、引发神经炎症,最终导致认知衰退。而小胶质细胞作为大脑的“常驻免疫细胞”,本应像清洁工一样清除这些“垃圾”,但在 AD 患者脑中,它们往往因长期炎症刺激而功能受损,甚至 “失职”。
研究团队将目光投向了 ACE——一种此前被发现与晚发性 AD 风险相关的蛋白。他们通过基因编辑技术,在 5xFAD 小鼠(一种经典的 AD 模型,会快速积累 Aβ 斑块并出现认知障碍)的小胶质细胞中特异性增强 ACE 的表达,结果观察到了显著的“逆转效应”:
斑块负荷大减:在海马体 CA1 区等易受损脑区,Aβ 斑块覆盖面积较对照组减少 3.5 倍,在杏仁核区域减少 2.6 倍;
神经元与突触获救:海马体下托和顶叶皮层 V 层的神经元密度显著回升,兴奋性突触(以 PSD95 和 vGlut1 共表达为标志)数量恢复至接近正常水平,且补体 C1q 介导的突触吞噬减少 2.6 倍;
认知能力显著改善:在 Barnes 迷宫测试中,ACE 增强的 AD 小鼠找到逃生盒的潜伏期缩短,记忆保留能力提升;恐惧条件反射实验显示,其 contextual 记忆(依赖海马体)和听觉线索记忆(依赖杏仁核)均明显恢复。
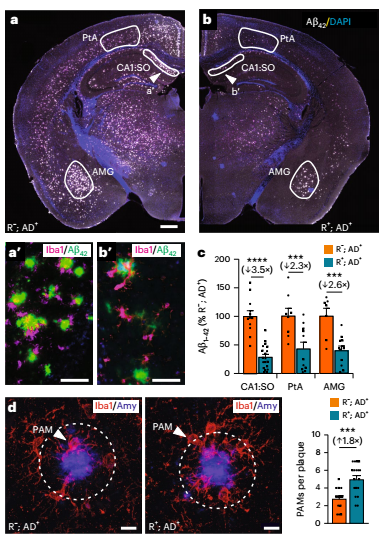
图:有和无ACE表达的5xFAD小鼠中的斑块负荷和PAM
ACE 如何赋予小胶质细胞 “超能力”?
深入研究发现,ACE 并非直接清除 Aβ,而是通过多重机制 “升级” 小胶质细胞的功能:
强化吞噬与降解:ACE 让小胶质细胞更主动地聚集在斑块周围(斑块相关小胶质细胞数量增加 1.8 倍),其吞噬 Aβ 的能力提升,且内溶酶体系统(以 CD68 标记)扩大 2.5 倍,能更高效地降解 Aβ;
激活关键信号通路:ACE 增强了小胶质细胞中脾酪氨酸激酶(SYK)的磷酸化 ——SYK 是 TREM2 和 CLEC7A 等 Aβ 受体下游的关键信号分子,其激活可进一步启动 mTOR、PI3K/Akt 等通路,促进细胞代谢和免疫功能;
重塑细胞状态:单细胞核测序显示,ACE 使小胶质细胞从 “疾病相关状态(DAM)” 向更具保护作用的表型转变,上调 165 个与吞噬、炎症调节相关的基因(如 Apoe、Trem2)。
更关键的是,这种增强效应依赖 ACE 的催化活性——当使用抑制剂(如赖诺普利)阻断 ACE 功能后,小胶质细胞的“超能力”消失,证实了 ACE 本身的酶活性在其中的核心作用。
小结
这项研究的意义不仅在于发现了 ACE 的新功能,更提供了一种潜在的细胞疗法思路:通过改造小胶质细胞细胞增强 ACE 表达,或许能克服 AD 中常见的免疫细胞功能缺陷。
目前,研究团队已在小鼠模型中验证了这种效应的特异性——ACE仅在小胶质细胞和脑相关巨噬细胞中表达,不影响神经元、星形胶质细胞等其他细胞,且未引发过度炎症。下一步,他们计划在人类小胶质细胞中验证这一机制,为临床转化铺路。
正如研究负责人 Warren Tourtellotte 博士所言:“AD 的核心困境之一是小胶质细胞‘无力’清除 Aβ,而 ACE 就像一把‘钥匙’,重新激活了它们的清洁能力。” 若未来能通过基因编辑或药物调控实现这一效果,或许能真正阻止甚至逆转 AD 的进展。
对于AD 患者而言,这一发现无疑是黑暗中的一缕光——当大脑的“清洁工”重获力量,记忆与尊严的守护或许不再遥远。(生物谷Bioon.com)
参考文献:
Andrew R. Gomez, Hyae Ran Byun, Shaogen Wu, et al. Boosting angiotensin-converting enzyme (ACE) in microglia protects against Alzheimer's disease in 5xFAD mice, Nature Aging (2025). DOI:10.1038/s43587-025-00879-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


